Kit per test RNase (Fluorescenza)
Descrizione
Il kit di rilevamento dell'RNasi si basa su una sonda RNA marcata con fluoroforo e consente ai ricercatori di misurare l'attività dell'RNasi.Quando il campione non contiene attività RNasi, la sonda è stabile e non produce un segnale fluorescente;quando il campione contiene attività RNasi, la sonda viene degradata, determinando un segnale di fluorescenza potenziato gradualmente;Il tasso di aumento del segnale di fluorescenza è positivamente correlato con il numero e l'attività degli enzimi.
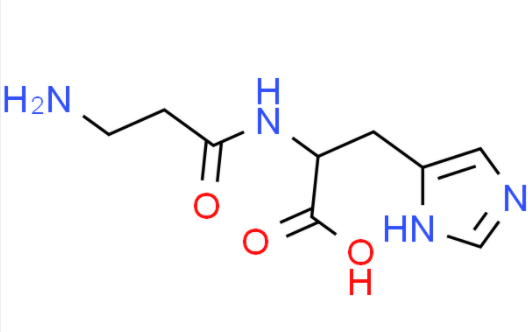
Struttura chimica
Composizione del corredo
| Nome | 48Prova | 192Prova |
| 10 × soluzione di reazione | 0,5 ml | 2,0 ml |
| Sonda dell'RNA | 1 tubo | 1 tubo |
| Tampone TE | 0,5 ml | 2,0 ml |
| Standard RNasi A (10 mg/mL) | 10μl | 20μl |
| Tampone di diluizione standard | 6ml | 12 ml |
| Acqua priva di DNasi&RNasi | 25ml | 25ml |
| DNasi RNasi via | 50ml | 50ml |
Specifica
| Articoli di prova | Specifiche |
| Aspetto | Imballaggio completo e nessuna perdita di liquido |
| Limite di rilevamento | RNasi A: 0,313 pg/ml |
| Precisione | CV intradosaggio ≤ 10% |
Trasporto e stoccaggio
Trasporto:Ghiaccio secco
Magazzinaggio:Conservare a -20°C (evitare ripetuti congelamenti e scongelamenti)
Ripetizione del test consigliata Vita:1 anno
prodotti correlati
Scrivi qui il tuo messaggio e inviacelo